Сплавы олова
Сплавы на основе олова также известны, как белые металлы, обычно содержат в своем составе медь, сурьму и свинец. Сплавы обладают различными механическими свойствами в зависимости от их состава.
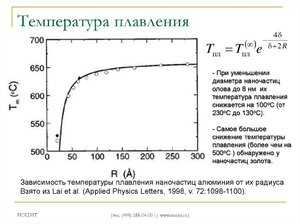
Сплавы олова со свинцом нашли свое коммерческое использование для широкого набора составов. Так, 61,9% олова и 38,1% свинца соответствуют эвтектическому составу, градус затвердевания которого составляет 183 °C. Сплавы с другим соотношением этих металлов плавятся и кристаллизуются в широком интервале температур, когда существует равновесие между твердой и жидкой фазами. При такой кристаллизации в расплаве начинают выделяться твердые сегрегации, которые приводят к образованию различных структур. Сплав эвтектического состава, так как имеет наименьшую температуру плавления, используется в качестве предохранителя от перегрева компонентов электроники.
Также существуют сплавы, в которых помимо указанных металлов присутствует небольшое количество сурьмы (до 2,5%). Основной проблемой сплавов на основе олова и свинца является их отрицательное влияние на экологию, поэтому в последнее время разрабатываются их заменители, в которых не используется свинец, например, сплавы с серебром и медью.
Сплавы олова со свинцом и сурьмой используют для декоративных украшений, а некоторые сплавы олова, меди и сурьмы используют в качестве смазки для уменьшения трения в подшипниках, благодаря их антифрикционным свойствам. Помимо вышесказанных сплавов, олово используют в бронзовых сплавах и в сплавах с титаном и цирконием.
- https://metalloy.ru/metally/olovo
- https://obrabotkametalla.info/splavy/temperatura-plavleniya-olova
- https://zen.yandex.ru/media/svarkapajka/kak-bez-truda-otlichit-chistoe-olovo-ot-pripoia-svinca-60758132063a3d24f993d93c
- https://chem.ru/olovo.html

Классификация металлов по температуре плавления
В физике переход твердого тела в жидкое состояние характерен только для веществ кристаллической структуры. Температуру плавления металлов чаще обозначают диапазоном значений, для сплавов точно определить нагрев до пограничного фазового состояния сложно. Для чистых элементов каждый градус имеет значение, особенно, если это легкоплавкие элементы,
значения не имеет. Сводная таблица показателей t обычно делится на 3 группы. Помимо легкоплавких элементов, которые максимально нагревают до +600°С, указывают тугоплавкие, выдерживающие нагрев свыше +1600°С, и среднеплавкие. В этой группе сплавы, образующие ванну расплава при температуре от +600 до 1600°С.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости
Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
- Увеличивается давление — увеличится величина плавления.
- Уменьшается давление — уменьшается величина плавления.
У разных веществ разные температуры плавления. Теоретически, металлы делят на:
- Легкоплавкие – достаточно температуры до 600 градусов Цельсия, для получения жидкого вещества.
- Среднеплавкие – необходима температура от 600 до 1600 ⁰С.
- Тугоплавкие – это металлы, для плавления которых требуется температура выше 1600 ⁰С.
Таблица легкоплавких металлов и сплавов (до 600 Со )
Ниже указана таблица с наименованием легкоплавких металлов и сплавов с температурой плавления до 600 Со.
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
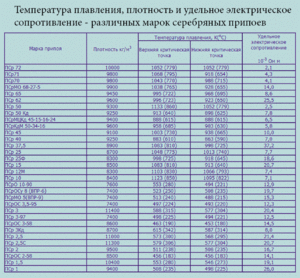
| Олово | Sn | 232 Со | 2600 Со |
| Свинец | Pb | 327 Со | 1750 Со |
| Цинк | Zn | 420 Со | 907 Со |
| Калий | K | 63,6 Со | 759 Со |
| Натрий | Na | 97,8 Со | 883 Со |
| Ртуть | Hg | — 38,9 Со | 356.73 Со |
| Цезий | Cs | 28,4 Со | 667.5 Со |
| Висмут | Bi | 271,4 Со | 1564 Со |
| Палладий | Pd | 327,5 Со | 1749 Со |
| Полоний | Po | 254 Со | 962 Со |
| Кадмий | Cd | 321,07 Со | 767 Со |
| Рубидий | Rb | 39,3 Со | 688 Со |
| Галлий | Ga | 29,76 Со | 2204 Со |
| Индий | In | 156,6 Со | 2072 Со |
| Таллий | Tl | 304 Со | 1473 Со |
| Литий | Li | 18,05 Со | 1342 Со |
Таблица среднеплавких металлов и сплавов (от 600С о до 1600Со )
Ниже указана таблица с наименованием среднеплавких металлов и сплавов с температурой плавления от 600 Со от 1600 Со.
| Название элемента | Латинское обозначение | Температураы | |
| Плавления | Кипения | ||
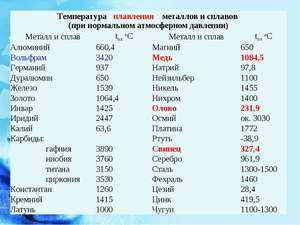
| Алюминий | Al | 660 Со | 2519 Со |
| Германий | Ge | 937 Со | 2830 Со |
| Магний | Mg | 650 Со | 1100 Со |
| Серебро | Ag | 960 Со | 2180 Со |
| Золото | Au | 1063 Со | 2660 Со |
| Медь | Cu | 1083 Со | 2580 Со |
| Железо | Fe | 1539 Со | 2900 Со |
| Кремний | Si | 1415 Со | 2350 Со |
| Никель | Ni | 1455 Со | 2913 Со |
| Барий | Ba | 727 Со | 1897 Со |
| Бериллий | Be | 1287 Со | 2471 Со |
| Нептуний | Np | 644 Со | 3901,85 Со |
| Протактиний | Pa | 1572 Со | 4027 Со |
| Плутоний | Pu | 640 Со | 3228 Со |
| Актиний | Ac | 1051 Со | 3198 Со |
| Кальций | Ca | 842 Со | 1484 Со |
| Радий | Ra | 700 Со | 1736,85 Со |
| Кобальт | Co | 1495 Со | 2927 Со |
| Сурьма | Sb | 630,63 Со | 1587 Со |
| Стронций | Sr | 777 Со | 1382 Со |
| Уран | U | 1135 Со | 4131 Со |
| Марганец | Mn | 1246 Со | 2061 Со |
| Константин | 1260 Со | ||
| Дуралюмин | Сплав алюминия, магния, меди и марганца | 650 Со | |
| Инвар | Сплав никеля и железа | 1425 Со | |
| Латунь | Сплав меди и цинка | 1000 Со | |
| Нейзильбер | Сплав меди, цинка и никеля | 1100 Со | |
| Нихром | Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400 Со | |
| Сталь | Сплав железа и углерода | 1300 Со — 1500 Со | |
| Фехраль | Сплав хрома, железа, алюминия, марганца и кремния | 1460 Со | |
| Чугун | Сплав железа и углерода | 1100 Со — 1300 Со |
Таблица тугоплавких металлов и сплавов (свыше 1600Со )
Ниже указана таблица с наименованием тугоплавких металлов и сплавов с температурой плавления свыше 1600 Со.
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Вольфрам | W | 3420 Со | 5555 Со |
| Титан | Ti | 1680 Со | 3300 Со |
| Иридий | Ir | 2447 Со | 4428 Со |
| Осмий | Os | 3054 Со | 5012 Со |
| Платина | Pt | 1769,3 Со | 3825 Со |
| Рений | Re | 3186 Со | 5596 Со |
| Хром | Cr | 1907 Со | 2671 Со |
| Родий | Rh | 1964 Со | 3695 Со |
| Рутений | Ru | 2334 Со | 4150 Со |
| Гафний | Hf | 2233 Со | 4603 Со |
| Тантал | Ta | 3017 Со | 5458 Со |
| Технеций | Tc | 2157 Со | 4265 Со |
| Торий | Th | 1750 Со | 4788 Со |
| Ванадий | V | 1910 Со | 3407 Со |
| Цирконий | Zr | 1855 Со | 4409 Со |
| Ниобий | Nb | 2477 Со | 4744 Со |
| Молибден | Mo | 2623 Со | 4639 Со |
| Карбиды гафния | 3890 Со | ||
| Карбиды ниобия | 3760 Со | ||
| Карбиды титана | 3150 Со | ||
| Карбиды циркония | 3530 Со |
Свойства металла

Олово относится к безопасным для человека веществам. В организм человека оно ежедневно попадает с пищей в минимальных пропорциях (0,25−3,4 мг). В теле содержится около (1−2).10-4% металла. Самая высокая концентрация выявляется в кишечнике. Регулярное вдыхание паров или воздушных частиц может нанести вред и привести к легочным заболеваниям. Людям, работающим с органическими сплавами олова, рекомендуется надевать защитные костюмы.
Причиной отравления может стать употребление старых консервов, в которых органические продукты реагируют с внутренним покрытием из олова, происходит окисление, при этом выделяется оловянистый водород. Роль вещества в организме человека практически не изучена. Металлическое олово считается нетоксичным для человека, поэтому применяется для покрытия жестяных тар для продуктов.
Физические характеристики
Плотность металла в твердой фракции при обычной температуре (+ 20−22˚С) составляет 7,3 г/см3, повышение показателей до температуры плавления олова (+231,8˚С) снижает плотность жидкого металла до 6,97 г/см3. Процесс кипения начинается в условиях температуры +2615˚С.
Другие факты:

- Показатель линейного расширения составляет 1,99.10-5 К-1 (при 0˚С), а при температуре +100˚С равняется 2,38.10-5 К-1.
- Удельная теплоемкость твердого вещества в обычном состоянии — 225 Дж/кг.К, а в жидком —в пределах 269 Дж/кг.К.
- Молярная теплоемкость белого олова — 27,1Дж/моль.К, серой модификации — 25,8 Дж/моль.К.
- Показатель плавления составляет 7,2 кДж/моль.
- Для испарения требуется 296 кДж/моль.
- Удельное сопротивление электричеству — 0,115−0,128 мкОм.м в условиях температуры +25˚С.
Химические показатели
Металл проявляет устойчивость к действию окружающего воздуха или влаги в условиях комнатной температуры. Инертность материала объясняется появлением оксидной пленки на поверхности. Олово начинает окисляться на воздухе при увеличении температуры свыше +150˚С. Металл обладает двумя окислительными степенями, +2 и +4. Первая имеет меньшую устойчивость.
Формулы характерных химических реакций:
- Холодная азотистая кислота реагирует с оловом, формула следующая: 4 Sn + 10 HNO 3 = NH 4 NO 3 + 4 Sn (NO 3) 2 + 3 H 2 O).
- В случае нагревания с концентрированной формой HN О 3 используется свойство окисления олова, при этом выделяется осадок с переменной гидратацией — 3 Sn + n H 2 O + 4 HNO 3 = 4 NO + 3 H 2 S n O 3 . n H 2 O.
- Нагревание олова в насыщенном щелочном растворе имеет обозначение по формуле 2 KOH + Sn + 4 H 2 O = 2 H 2 + K 2 (Sn (OH) 6).
Применение олова
- Этот элемент часто используют в качестве защитного слоя в атомной промышленности.
- Его также применяют в стекольной промышленности как полировку для стекла, оно в жидком состоянии выливается в емкость с расплавом.
- В печатной промышленности используется сплав олова с сурьмой и свинцом для создания печатного шрифта.
- Оловом прокатывают фольгу, элемент применяют в производстве труб и различных деталей, чтобы придать им антикоррозийную стойкость, ведь олово не ржавеет.
- Редкий элемент отлично проводит тепло, например, в производстве консервных банок он часто используется. В такой таре можно длительное время хранить продукты, поскольку олово нетоксичный элемент. Посуда долгий промежуток времени не подвергается разрушению.
- В ткацкой промышленности он также используется, но только соли металла. В основном это находит применение в производстве натурального шелка и для печати на ситцевой ткани.
- Элемент нашел применение и в медицине, например, в стоматологии для армирования некоторых видов пломб. Редкий металл есть даже в организме человеке, его нехватка может отрицательно сказаться на росте, по этой причине он начинает замедляться.
Общие свойства олова
Все свойства этого металла можно разделить на две большие группы: физические и химические.
Физические характеристики
Это серебристый ковкий металл, который легко окисляется при температуре окружающей среды, при этом цвет олова изменяется на темно-серый. Если согнуть пластину из этого металла, то можно услышать характерный звук, так называемый «крик олова», который возникает из-за трения между составляющими его кристаллами. Одной из ярко выраженных его характеристик является резкое ухудшение механических свойств при определенных условиях, носящее название «оловянная чума»: ниже температуры -18 °C происходит разрушение металла, и он начинает выглядеть, как серый порошок.
Чистое олово имеет две аллотропных модификации: серую и белую. Серая модификация имеет кубическую кристаллическую структуру, является полупроводником, очень хрупкая, имеет низкую плотность и стабильна при температуре ниже 13,2 °C. Белая аллотропная модификация имеет тетрагональную кристаллическую структуру, хорошо проводит электрический ток и стабильна при температурах выше 13,2 °C.
Плавится металл при относительно низкой температуре 232 °C (для сравнения: железо плавится при 1535 °C). При этом необходимо понимать, отвечая на вопрос, при какой температуре плавится олово, что плавится именно его белая аллотропная модификация. Несмотря на низкую температуру плавления, кипение металла происходит при относительно высокой температуре 2602 °C (железо кипит при 2750 °C).
Химические свойства
Наиболее важным минералом является касситерит, SnO2. Однако, в настоящее время неизвестны рудные месторождения с высоким процентным содержанием этого минерала. Большую часть касситерита в мире добывают из наносных залежей низкого качества. Именно из этого минерала получают олово в промышленных масштабах. Для этого касситерит измельчают, получая его концентрат, а затем он подвергается плавке вместе с коксом, кварцем и известью в доменной печи. После этого отливки в виде блоков проходят окончательную очистку от примесей висмута, меди и железа.
Химический элемент олово хорошо реагирует как с сильными кислотами, так и с сильными основаниями, однако относительно инертен в нейтральных растворах. Подвергается коррозии в присутствии окислительных сред, в отсутствии кислорода металл практически не подвергается коррозии. При окислении на поверхности металла образуется плотная оксидная пленка, которая защищает остальную его часть от дальнейшего окисления.
Если при растворении солей в воде образуется кислая среда, тогда в присутствии окислителей или воздуха олово вступает в реакцию. К таким солям относятся хлориды, например, алюминия и железа. Большинство неводных жидкостей, например, масла и спирты практически не вступают в реакцию с оловом. Само олово и его простые неорганические соли не являются токсичными, однако, некоторые органические композиты обладают токсичностью.
Оксид олова (II), SnO является кристаллом черно-синего цвета, который растворяется в кислотах и основаниях. Его используют для производства солей в гальванопластике и при производстве стекла. Оксид олова (IV), SnO2 представляет собой белую пыль, нерастворимую в кислотах. Его используют в качестве незаменимого компонента для окраски в розовых, желтых и коричневых керамиках, а также в диэлектриках и тугоплавких сплавов. Он является важным агентом при полировке мрамора и других декоративных камней.
Хлорид олова (II), SnCl2 является основным ингредиентом в оловянной кислоте для пайки. Хлорид олова (IV), SnCl4 используется в качестве химического ингредиента для придания веса шелковой ткани, а также для стабилизации некоторых парфюмерных продуктов и стабилизации цвета мыла, а SnF2, имеющий белый цвет и растворимый в воде, применяется в качестве добавки к зубным пастам.
Органические химические соединения на основе этого элемента — это такие соединения, в которых присутствует хотя бы одна связь олова с водородом, Sn-H, и в которых металл проявляет степень окисления +4. Органические соединения, которые нашли свое приложение в индустрии, обладают следующими химическими формулами:
- R4Sn;
- R3SnX;
- R2SnX2;
- RSnX3.
Здесь R — органическая группа, например, метил, этил, бутил и другие, а X — неорганический элемент, например, хлор, кислород, флор и другие.
Виды чугуна
Существует несколько видов чугуна. В него добавляют различные легирующие примеси, которые изменяют характеристики цельного материала. Для этого используют алюминий, хром, ванадий или никель. В дополнение к ним идут и другие примеси. Параметры готовых изделий напрямую зависят от состава сплава. Разновидности:
- Серый чугун. Считается самым популярным видом. В составе содержится 2,5% углерода, который представляет собой частицу графита или перлита. Обладает высоким показателем прочности. Из серого чугуна делают детали, выдерживающие постоянные нагрузки. Это могут быть зубчатые шестерни, детали корпусов, втулки.
- Белый чугун. Углерод, содержащийся в составе, представляет собой частицы карбида. На изломе материала остаётся белый след, что соответствует названию. Содержание углерода в среднем более 3%. Хрупкая и ломкая разновидность материала, из-за чего его используют только в статических деталях.
- Половинчатый. Объединяет в себе характеристики двух предыдущих видов чугуна. Частицы графита и карбида насыщают металл углеродом. Его содержание от 3,5 до 4,2%. Износоустойчивый материал, который используется в машиностроении. Выдерживает постоянное трение.
- Ковкий чугун. Получается из второй разновидности материала, после проведения отжига. Сплав содержит углерод в виде частиц феррита. Его количество — около 3,5%. Как и половинчатый используется для изготовления деталей в машиностроении.
Общие свойства олова
Все свойства этого металла можно разделить на две большие группы: физические и химические.
Физические характеристики
 Это серебристый ковкий металл, который легко окисляется при температуре окружающей среды, при этом цвет олова изменяется на темно-серый. Если согнуть пластину из этого металла, то можно услышать характерный звук, так называемый «крик олова», который возникает из-за трения между составляющими его кристаллами. Одной из ярко выраженных его характеристик является резкое ухудшение механических свойств при определенных условиях, носящее название «оловянная чума»: ниже температуры -18 °C происходит разрушение металла, и он начинает выглядеть, как серый порошок.
Это серебристый ковкий металл, который легко окисляется при температуре окружающей среды, при этом цвет олова изменяется на темно-серый. Если согнуть пластину из этого металла, то можно услышать характерный звук, так называемый «крик олова», который возникает из-за трения между составляющими его кристаллами. Одной из ярко выраженных его характеристик является резкое ухудшение механических свойств при определенных условиях, носящее название «оловянная чума»: ниже температуры -18 °C происходит разрушение металла, и он начинает выглядеть, как серый порошок.
Чистое олово имеет две аллотропных модификации: серую и белую. Серая модификация имеет кубическую кристаллическую структуру, является полупроводником, очень хрупкая, имеет низкую плотность и стабильна при температуре ниже 13,2 °C. Белая аллотропная модификация имеет тетрагональную кристаллическую структуру, хорошо проводит электрический ток и стабильна при температурах выше 13,2 °C.
 Плавится металл при относительно низкой температуре 232 °C (для сравнения: железо плавится при 1535 °C). При этом необходимо понимать, отвечая на вопрос, при какой температуре плавится олово, что плавится именно его белая аллотропная модификация. Несмотря на низкую температуру плавления, кипение металла происходит при относительно высокой температуре 2602 °C (железо кипит при 2750 °C).
Плавится металл при относительно низкой температуре 232 °C (для сравнения: железо плавится при 1535 °C). При этом необходимо понимать, отвечая на вопрос, при какой температуре плавится олово, что плавится именно его белая аллотропная модификация. Несмотря на низкую температуру плавления, кипение металла происходит при относительно высокой температуре 2602 °C (железо кипит при 2750 °C).
Химические свойства
 Наиболее важным минералом является касситерит, SnO2. Однако, в настоящее время неизвестны рудные месторождения с высоким процентным содержанием этого минерала. Большую часть касситерита в мире добывают из наносных залежей низкого качества. Именно из этого минерала получают олово в промышленных масштабах. Для этого касситерит измельчают, получая его концентрат, а затем он подвергается плавке вместе с коксом, кварцем и известью в доменной печи. После этого отливки в виде блоков проходят окончательную очистку от примесей висмута, меди и железа.
Наиболее важным минералом является касситерит, SnO2. Однако, в настоящее время неизвестны рудные месторождения с высоким процентным содержанием этого минерала. Большую часть касситерита в мире добывают из наносных залежей низкого качества. Именно из этого минерала получают олово в промышленных масштабах. Для этого касситерит измельчают, получая его концентрат, а затем он подвергается плавке вместе с коксом, кварцем и известью в доменной печи. После этого отливки в виде блоков проходят окончательную очистку от примесей висмута, меди и железа.
Химический элемент олово хорошо реагирует как с сильными кислотами, так и с сильными основаниями, однако относительно инертен в нейтральных растворах. Подвергается коррозии в присутствии окислительных сред, в отсутствии кислорода металл практически не подвергается коррозии. При окислении на поверхности металла образуется плотная оксидная пленка, которая защищает остальную его часть от дальнейшего окисления.
 Если при растворении солей в воде образуется кислая среда, тогда в присутствии окислителей или воздуха олово вступает в реакцию. К таким солям относятся хлориды, например, алюминия и железа. Большинство неводных жидкостей, например, масла и спирты практически не вступают в реакцию с оловом. Само олово и его простые неорганические соли не являются токсичными, однако, некоторые органические композиты обладают токсичностью.
Если при растворении солей в воде образуется кислая среда, тогда в присутствии окислителей или воздуха олово вступает в реакцию. К таким солям относятся хлориды, например, алюминия и железа. Большинство неводных жидкостей, например, масла и спирты практически не вступают в реакцию с оловом. Само олово и его простые неорганические соли не являются токсичными, однако, некоторые органические композиты обладают токсичностью.
Оксид олова (II), SnO является кристаллом черно-синего цвета, который растворяется в кислотах и основаниях. Его используют для производства солей в гальванопластике и при производстве стекла. Оксид олова (IV), SnO2 представляет собой белую пыль, нерастворимую в кислотах. Его используют в качестве незаменимого компонента для окраски в розовых, желтых и коричневых керамиках, а также в диэлектриках и тугоплавких сплавов. Он является важным агентом при полировке мрамора и других декоративных камней.
Хлорид олова (II), SnCl2 является основным ингредиентом в оловянной кислоте для пайки. Хлорид олова (IV), SnCl4 используется в качестве химического ингредиента для придания веса шелковой ткани, а также для стабилизации некоторых парфюмерных продуктов и стабилизации цвета мыла, а SnF2, имеющий белый цвет и растворимый в воде, применяется в качестве добавки к зубным пастам.
Органические химические соединения на основе этого элемента — это такие соединения, в которых присутствует хотя бы одна связь олова с водородом, Sn-H, и в которых металл проявляет степень окисления +4. Органические соединения, которые нашли свое приложение в индустрии, обладают следующими химическими формулами:
- R4Sn;
- R3SnX;
- R2SnX2;
- RSnX3.
Здесь R — органическая группа, например, метил, этил, бутил и другие, а X — неорганический элемент, например, хлор, кислород, флор и другие.
Свойства и особенности олова
Оловянные сплавы имеют малый коэффициент трения, из-за чего их используют в разнообразных антифрикционных материалов. Помимо этого, данным свойством они могут наделять и прочие вещества. Это значительно продлевает период эксплуатации механизмов, машин, значительно снижая потери на трение. К интересной особенности данного материала относится его увеличение объема на 25,6 % при температуре + 13,2 °С. Этот металл называется серым.
При снижении температуры до – 33,0 °С вещество кристаллизуется и переходит в порошкообразное состояние. При взаимодействии серого и белого олова происходит передача свойств белому металлу. Разнообразные оловянные сплавы широко используются электротехнической промышленностью. На вопрос при какой температуре плавится олово существует однозначный ответ: + 231,9 °С или же 505,1 по кельвину. Это весьма удобно для радиолюбителей, ведь паять детали с такой температурой можно без особых проблем даже в домашних условиях. Температура плавления, при которой олово переходит в жидкое состояние невысока, что облегчает его использование.
Человеческое тело содержит оловянные вещества в костях, где они помогают обновлению костной ткани. Для нормальной жизнедеятельности организму необходимо получать ежедневно порядка 2-10 мг металла в сутки. Этот макроэлемент содержится в принимаемой пище, однако усваивается всего лишь до 5 % от общего поступающего количества.
Таблица удельной теплоты плавления
Значение удельной теплоты для разных веществ: золота, серебра, цинка, олова и многих других металлов можно найти в специальных таблицах и справочниках. Обычно эти значения приводятся в виде таблицы.
Вашему вниманию таблица удельной теплоты плавления разных веществ
| Вещество | 105 * Дж/кг | ккал/кг | Вещество | 105 * Дж/кг | ккал/кг |
| Алюминий | 3,8 | 92 | Ртуть | 0,1 | 3,0 |
| Железо | 2,7 | 65 | Свинец | 0,3 | 6,0 |
| Лед | 3,3 | 80 | Серебро | 0,87 | 21 |
| Медь | 1,8 | 42 | Сталь | 0,8 | 20 |
| Нафталин | 1,5 | 36 | Цинк | 1,2 | 28 |
| Олово | 0,58 | 14 | Платина | 1,01 | 24,1 |
| Парафин | 1,5 | 35 | Золото | 0,66 | 15,8 |
Интересный факт: самым тугоплавким металлом на сегодняшний день является карбид тантала – ТаС. Для его плавления необходима температура 3990 С. Покрытия из ТаС применяют для защиты металлических форм, в которых отливают детали из алюминия
Что такое олово и висмут?
Олово
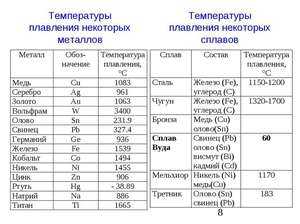
— мягкий металл серебристо-белого цвета. Плотность 7,28 г/см3, температура плавления 232°С, атомная масса 118,7 г/моль. В атмосферных условиях, даже в присутствии влаги, олово окисляется медленно. Разбавленные растворы минеральных кислот при комнатной температуре практически не растворяют олово, оно растворяется в концентрированных серной и соляной кислотах при нагревании. В растворах едкой щелочи олово неустойчиво и при нагревании растворяется с образованием станнатов. С органическими кислотами олово образует комплексные соединения, причем потенциал олова становится более отрицательным, чем потенциал железа, т.е. олово становится анодным покрытием.
Коррозионная стойкость олова в зависимости от рН приведена на рисунке 1. Видно, что олово наиболее устойчиво в диапазне рН от 6 до 9.
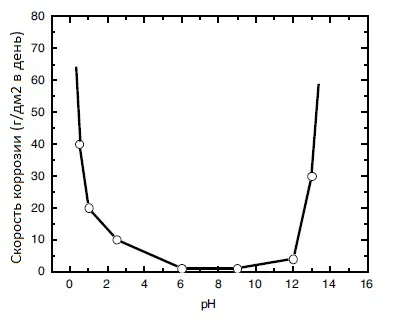
Рисунок 1 — Зависимость скорости коррозии олова от величины рН среды.
Висмут
— в нормальных условиях блестящий серебристо-белый металл. Плотность 9,747 г/см³ температура плавления 271,35 °C, атомная масса 208,98 г/моль. В соединениях висмут проявляет степени окисления -3, +1, +2, +3, +4, +5. При комнатной температуре в среде сухого воздуха не окисляется, но в среде влажного воздуха покрывается тонкой плёнкой оксида. С металлами способен образовывать интерметаллиды — висмутиды.
Олово-висмутовое покрытие нашло самое широкое применение в радиоэлектронике и электротехнике. Чаще всего оловом покрываются токоведущие медные и алюминиевые шины, электроконтакты, корпуса приборов, крепеж из нержавеющей стали, контактирующий с алюминием (рисунок 2,3).
Рисунок 2 — Примеры оловянированных медных шин.
Рисунок 3 — Примеры оловянированных корпусных деталей.
Чисто оловянные покрытия просты в получении, но имеют ряд существенных недостатков:
(более подробно о некоторых из них написано в статье)
• При хранении оловянных покрытий характерен рост на их поверхности нитевидных кристаллов, длина которых может достигать величины 5-10 мм (рисунок 4). Нитевидные кристаллы вызывают короткие замыкания при эксплуатации плотно расположенной электрорадиотехнической аппаратуры. Причины возникновения подобных несовершенств покрытия еще недостаточно изучены. Установлено, что на образование усов в значительной степени влияет материал катода. Основной причиной считается наличие внутренних напряжений сжатия в покрытии, которые возникают под влиянием осаждения некоторых примесей, инородных включений, диффузии компонентов основы в покрытие, напряжений в материале основы. На оловянном покрытии, нанесенном на латунь, медь и цинк нитевидные кристаллы появляются чаще и растут быстрее, чем на стальной основе. Применение никелевого подслоя тормозит этот процесс.
Рисунок 4 — «Усы» на олове.
• Олово является полиморфным металлом. В обычных условиях оно существует в виде β-модификации (белое олово), устойчивой выше 13,2 °C. При низких температурах белое олово переходит в другую аллотропную модификацию (серое олово). Переход сопровождается увеличением удельного объема, что приводит к разрушению оловянного покрытия. Это явление получило название «оловянная чума» (рисунок 5).
Рисунок 5 — Оловянный стержень, пораженный «оловянной чумой».
• Чисто оловянные покрытия имеют очень короткий срок эксплуатации в качестве покрытия под пайку. Практика показывает, что паяемость оловянного покрытия иногда ухудшается в течение 2-3 суток. Неблагоприятно сказывается значительная пористость покрытия, наличие в покрытии примесей некоторых металлов, которые включаются в процессе электрокристаллизации или в результате диффузии компонентов металла основы, например цинка из латуни. Так же паяемость луженой поверхности может уменьшаться вследствие образования на границе медь-олово интерметаллических соединений типа Cu3Sn, Cu6Sn5, которые при толщине меньше 3 мкм теряют пластичность.
Все эти недостатки устраняются при введении в олово висмута.
Диаграмма состояния сплава олово-всимут приведена на рисунке 6. Однако, стоит заметить, что гальванические сплавы олово-висмут легируются висмутом всего на десятые доли процента — этого уже достаточно для модификации свойств покрытия.
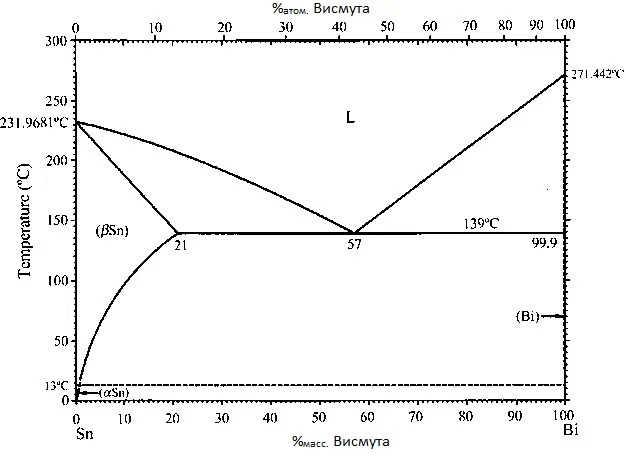
Рисунок 6 — Диаграмма состояния олово-висмут.
Для осаждения олова и его сплавов используют различные по природе электролиты, основными являются кислые и щелочные.

































